Neilton Lima
Professor de Química.
Olá, pessoal!
Nossa Química vai rolar por aqui, também! Através do seu celular ou computador você poderá acessar as informações mais importantes das nossas aulas e revisar os conteúdos. Bons estudos!!!
Nosso primeiro assunto, "Como medir as substâncias e seus átomos e moléculas?", começou abordando as grandezas físicas: volume, massa e numerosidade.
Será que uma água mineral é pura? Se "pura" for entendido como "limpa" ou "potável", talvez seja. Mas, no campo da Química, a água mineral é "uma solução aquosa de vários solutos diferentes". Leia no rótulo a variedade de solutos que estão diluídos nessa simples água.
Nosso primeiro assunto, "Como medir as substâncias e seus átomos e moléculas?", começou abordando as grandezas físicas: volume, massa e numerosidade.
Será que uma água mineral é pura? Se "pura" for entendido como "limpa" ou "potável", talvez seja. Mas, no campo da Química, a água mineral é "uma solução aquosa de vários solutos diferentes". Leia no rótulo a variedade de solutos que estão diluídos nessa simples água.
Sendo assim, será preciso compreendermos alguns conceitos. Vejamos:
Dicionário de Conceitos
de Química:
¢ Misturas
heterogêneas: apresentam duas ou mais fases, ou seja, porções com propriedades
distintas.
¢ Misturas
homogêneas (ou Soluções): apresentam uma única fase, ou seja, têm
as mesmas propriedades em todos os seus pontos.
¢ Solução: qualquer
mistura homogênea. A propriedade que a substância tem de misturar-se ou
dissolver-se a outra. Pode ser líquida, gasosa ou sólida.
Ex1: um pouco de açúcar ou sal bem dissolvidos na água em uma só fase
(solução aquosa de açúcar ou sal).
Ex2: A preparação de um refresco: produto em pó dissolvido em água, seguindo
a orientação da embalagem sobre a quantidade exata.
¢ Solução
aquosa: solução preparada com o solvente água.
¢ Solvente: quando
uma substância é capaz de dissolver outra.
Ex1: A quantidade adequada de água para o preparo de um refresco.
¢ Soluto: a
substância que é dissolvida num solvente, a fim de fazer uma solução.
Ex1: O pó da embalagem de um refresco.
¢ Concentração
comum de uma solução (C): expressa a massa qualquer de um soluto
(mg, g, kg, t etc.) presente num certo volume qualquer de solução (cm3, mL, dm3,
L, m3 etc.).
Importante: o volume que se leva em conta aqui
nessa definição não é o volume de solvente usado para fazer a solução, mas sim
o volume da solução (já com seu soluto diluído).
Ex1: Em um refresco com o sabor desejado, há uma determinada
concentração do soluto. No refresco “aguado”, essa concentração é menor, e no
refresco “forte” ela é maior.
Esquematizando tudo o que foi dito, resumiríamos assim:
Isso significa que, ao trabalhar com misturas e soluções, os químicos precisam usar unidades de medidas.
Grandezas Físicas – volume, massa e numerosidade.
¶
Grandeza: tudo o que
podemos medir. É um atributo (característica) de algo do universo físico que
pode ser medido de alguma forma. Toda grandeza é representada por um número
seguido de uma unidade de medida (de comprimento, volume, massa, tempo, entre
outras).
¶
Além
do volume e da massa, o químico utiliza a numerosidade
(é o conjunto de várias unidades que usamos no dia a dia: saco, lata, dúzia,
litro, copo, unidades...) como outra importante grandeza. Mas, nem sempre ela é
apropriada. Da mesma maneira, para os químicos, é inviável contar átomos ou
moléculas. Eles geralmente trabalham medindo massas.
¶
Nos
cálculos de quantidades de substâncias, envolvidas em reações químicas, é
fundamental estabelecer as quantidades numéricas dos constituintes que estão
reagindo para a determinação da porção dos produtos a serem formados.
Até aqui, já poderíamos tirar boas razões ou bons motivos para aprender cálculos químicos:
1. O remédio pode se transformar em veneno, e vice-versa;
2. Você pode salvar ou perder vida (preparando um medicamento);
3. Evitar fraudes (adulteração de combustíveis, por exemplo);
4. Evitar desperdícios, danos econômicos, sociais e ambientais.
Vejamos então uma possível situação bem concreta do cotidiano...
A solução pode ser encontrada com uma simples regra de três:
Podemos então levantar alguns questionamentos dessa situação:
1. Como preparar cuidadosamente uma solução?
2. Como transformar unidades de medida de massa e volume?
Moral da História:
Conclusão tirada desse estudo.
Conclusão tirada desse estudo.
¢ É de suma importância saber a correta interpretação de informações contidas em rótulos que expressam concentração de soluções. Se, no rótulo de um frasco que contém uma solução aquosa, existe a informação de que ela é 50g/L, isso deve ser interpretado como: existem 50 g de soluto em cada litro de solução.
¢ Como esse valor de 50g/L equivale à presença de 50 mg de soluto em cada mililitro de solução, assim também podemos dizer que a concentração da solução é 50mg/mL.
Sabendo disso pessoal, por isso pedi o seguinte trabalho ou pesquisa individual: "Desenhe as três Unidades de Medida de MASSA, VOLUME e COMPRIMENTO, com seus submúltiplos e múltiplos". Bem, a maioria de vocês me apresentou o seguinte esquema:
Mas, eu mesmo elaborei uma outra forma de explicar e entender tais transformações. Vamos tomar a UNIDADE DE MEDIDA DE MASSA como base:
Bem, cabe então duas conclusões importantes para encerrarmos com alguns exercícios que fizemos em sala.
1ª)
2ª)
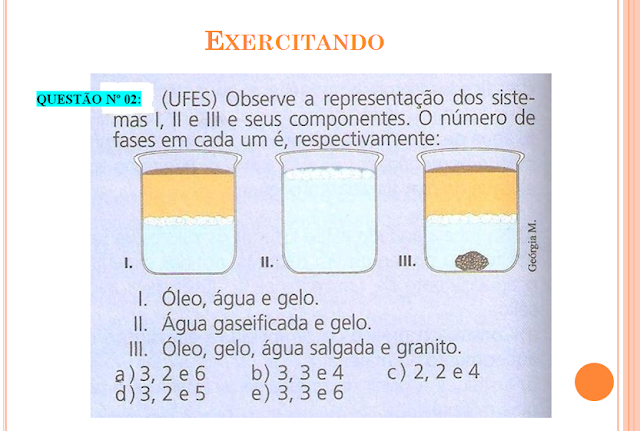
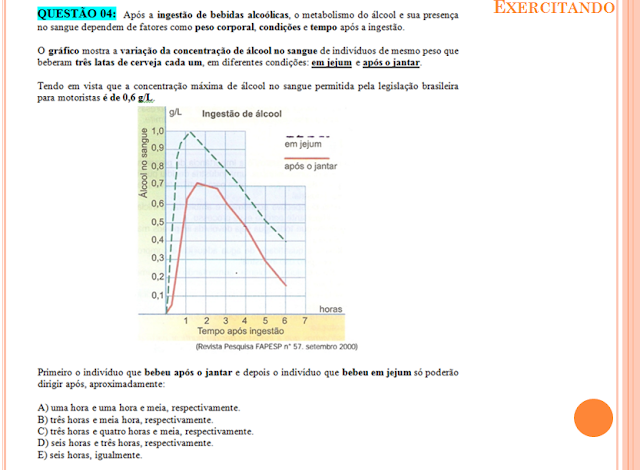
Vamos aos exercícios:
GABARITO:
01. A
02. E
03. D
04. C
Aquele Abraço!
Neilton Lima






















Nenhum comentário:
Postar um comentário