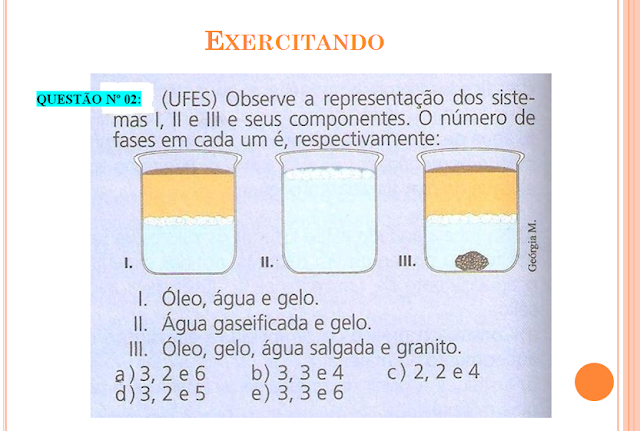
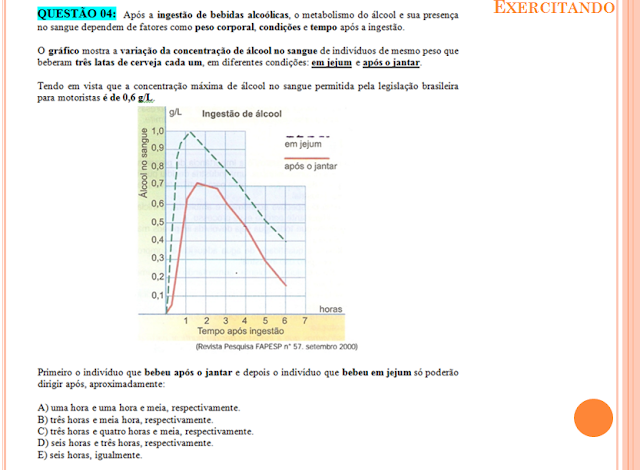
Neilton Lima
Professor
de Química.
Olá, pessoal!
Nossa Química vai
rolar por aqui, também! Através do seu celular ou computador você poderá acessar
as informações mais importantes das nossas aulas e revisar os conteúdos. Bons
estudos!!!
Por que não chamar apenas "Química"? Porque ela é muito abrangente e complexa. Para facilitar o seu estudo, ela é dividida por temas. Logo, as áreas em que a Química está dividida são:
 |
1. Química Geral: é o suporte ou alicerce de todas as químicas.
|
 |
2. Química Orgânica: a nossa química... A parte da Química que estuda a maior parte dos Compostos de Carbono. O Carbono é o elemento presente em todas as moléculas de substâncias
orgânicas. Porém, muitos compostos com Carbono não estão associados a organismos vegetais ou animais, direta e indiretamente.
|
 |
3. Química Inorgânica: tem a responsabilidade de estudar todos os elementos existentes na Tabela Periódica.
|
 |
4. Físico-Química: é mais sofisticada porque junta o conhecimento da Física e da Química e tem como ferramenta a Matemática.
|
 |
5. Química Analítica: é a química da qualificação e quantificação de elementos e substâncias.
|
 |
| 6. Bioquímica: estuda as biomoléculas. |
Galera, atualmente também sou professor de Química no curso Técnico Profissionalizante em Comércio e Vendas. É importante saber sobre os dois procedimentos essenciais em um laboratório, quando se
deseja estudar compostos orgânicos: a análise e a síntese.
1.
Análise:
isola e identifica os compostos químicos presentes em determinado material. Ex:
a extração de produtos naturais de plantas.
1.1
Análise qualitativa: de uma essência vegetal, por exemplo,
pressupõe a separação das substâncias que a constituem, seguida da
identificação de cada uma delas. Uma análise química pode envolver métodos
convencionais ou o uso de instrumentos com moderna tecnologia.
1.2 Análise
quantitativa: geralmente complementa a anterior, pois tem por finalidade
determinar o teor de cada componente em uma mistura.
2.
Síntese:
procura-se produzir, em laboratório, materiais com características idênticas ou
muito parecidas às dos compostos naturais ou de materiais inexistentes na
natureza e com características específicas.
Ex: produção de borracha
sintética, medicamentos como o ácido acetilsalicílico (pela indústria
farmacêutica), produtos fabricados pela indústria química, etc. Todos esses
produtos são provindos de processos de síntese.
Nosso primeiro assunto, "Introdução
à Química dos Compostos de Carbono", destacamos:
Química tem história!
A história da Química Orgânica...
¶
Por muito tempo se acreditou que os compostos orgânicos não
poderiam ser sintetizados em laboratório, porque alguns químicos acreditavam
que na matéria viva havia uma “força vital” que não poderia ser criada em
laboratório pelos meios científicos conhecidos. Berzelius foi o responsável
pela difusão dessa teoria.
01. Afinal, a Química Orgânica
estuda o quê? A química orgânica está presente no nosso dia a dia. Neste momento existe uma série de reações ou transformações metabólicas, onde moléculas orgânicas estão envolvidas.
Dica do Professor: Não
confunda o objeto de estudo da
Química Orgânica!
Existem na Natureza, minerais
formados de puro carbono, exemplos:
- diamantes, o carvão e a grafite.
Também existem compostos
sem carbono, exemplos:
-
N2O ou óxido nitroso, um
anestésico geral.
E ainda há muitos compostos
com Carbono, mas que não estão associados a organismos vegetais ou animais, exemplos:
- o carbonato de cálcio (CaCO3),
presente no mármore;
- o hidrogeno-carbonato de
sódio (NaHCO3), também conhecido por bicarbonato de sódio, substância usada
como antiácido e como fermento químico;
- o monóxido de carbono
(CO) e o dióxido de carbono (CO2);
- o ácido carbônico (H2CO3),
o ácido cianídrico (HCN) e os carbonatos e cianetos (sais derivados do ácido
carbônico e do ácido cianídrico: (Na2CO3),
(CaCO3) e (NaCN).
CO2).
Substâncias que apresentam
átomos de carbono, mas que não são produzidas por organismos vivos, são
estudadas principalmente pela Química
Inorgânica, que tem como foco de pesquisa os compostos de origem mineral. Então...
CONCLUSÃO: A Química
Orgânica é entendida, hoje, como a Química
que estuda a maior parte dos compostos de Carbono. Mais de 95% de todas as substâncias conhecidas contêm átomo de carbono em sua
composição. Incluem-se aqui os derivados de petróleo (um óleo que surge de restos
orgânicos de animais e vegetais) e seus derivados, como plásticos e diversos
outros materiais, biocombustíveis (etanol e biomassa = matéria orgânica) etc.
02. Todas as formas de vida que conhecemos aqui na
Terra se compõem principalmente de 06
elementos básicos ou essenciais:
03.
Qual é a importância
da Química Orgânica?
¢ Compreender os
processos que ocorrem nos seres vivos.
¢ As primeiras
preocupações da Química Orgânica nascente eram os materiais de origem animal e
vegetal, tais como urina, sangue, gorduras, cabelo, açúcares, resinas, ceras
etc.
¢ Na Medicina, a
Química Orgânica encontra um grande campo de atuação, uma vez que a grande
maioria dos medicamentos é formada por compostos orgânicos.
¢ A Química
Orgânica também é importante colaboradora da Bioquímica, que se ocupa com o
estudo das substâncias presentes nos organismos vivos e dos processos químicos
que neles ocorrem.
A palavra "orgânico" vem do grego. E o átomo mais queridinho aqui é o Carbono.
04.
Como os químicos
representam o carbono e suas cadeias encontradas na Natureza?
Esse carbono faz ligações em cadeia:
05.
Como os átomos se unem na
Química Orgânica para formar as moléculas com suas cadeias?
Dica do Professor:
Pessoal, quem dá a resposta a essa pergunta é o químico alemão August Kekulé (1829-1896). É dele que
veio a ideia de
ligações covalentes, organizadas em três postulados:
1. O
Carbono é Tetravalente.
2. As
Valências são Equivalentes.
3. O
Carbono tem Capacidade de Formar Cadeias.
Meus queridos alunos, para
entender os 03 postulados de Kekulé precisamos saber que existem três tipos de
ligações. Entre elas há a ligação forte (SIGMA = σ) e a ligação fraca (PI
= π).
1º postulado de
Kakulé: “O Carbono é Tetravalente”.
“tetra” (04 vezes) e “valente” (ligação).
O Carbono faz 04 ligações.
Eis então os principais elementos formadores de matéria orgânica e quantas ligações covalentes eles podem formar:
2º postulado de
Kakulé: “As Valências são Equivalentes”. Isso significa que não importa a ordem
dos átomos ligados ao Carbono (se ele fica na esquerda ou direita, em cima ou
embaixo). Vejam:
3º postulado de
Kakulé: “O Carbono tem Capacidade de Formar Cadeias”. O Carbono
é o único elemento capaz do formar cadeias longas e estáveis. Observe aí
galera, que: temos uma Cadeia de Carbono (08 átomos de C), com ligações
simples, dupla e tripla. Mas, ela está incompleta referente ao seu número
de valência (que, como vimos, são 04 ligações).
Então, pendurando os hidrogênios para completar as cadeias de Carbono, ela ficará assim:
¢ Repare
que a primeira cadeia está fechada e
essa está aberta. Acaba de nascer um
conceito importante da Química Orgânica:
chamamos de “Fórmula Estrutural” a representação de todos os átomos de
uma cadeia.
Vale ainda destacar aqui o modelo de Lewis, um químico estadunidense (1875-1946). Vejamos as principais características do seu modelo:
A Fórmula Eletrônica de Lewis
¶
A representação da estrutura eletrônica dos átomos para moléculas
orgânicas consistem em escrever todos os elétrons da camada de valência para
cada átomo de maneira explícita.
¶
Cada ligação covalente é representada por meio de um par de
elétrons da camada de valência dos átomos envolvidos.
¶
As ligações covalentes são representadas por meio do
compartilhamento entre os átomos, procurando sempre seguir o modelo do octeto.
¶
O importante é mostrar o número de elétrons da camada de valência
para cada átomo e como o compartilhamento é feito de acordo com o modelo
octeto.
¶
É preciso destacar que, com o hidrogênio, somente dois elétrons
podem ser compartilhados, pois ele apresenta apenas uma camada eletrônica.
¶
Em uma molécula orgânica na qual dois átomos de carbono se ligam
entre si por meio de uma ligação tripla, a ligação restante para cada carbono é
feita com o hidrogênio.
E por falar em conceito, vejamos
mais alguns outros muito importantes:
¢ “Esqueleto
da Molécula” = Cadeia Carbônica.
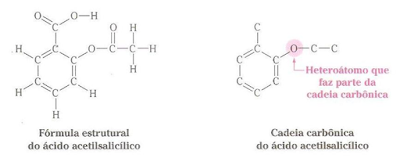
¢ Heteroátomo:
Qualquer átomo em uma molécula orgânica que não seja de carbono ou de hidrogênio.
Isso porque átomos do elemento carbono estão presentes em todas as
moléculas orgânicas. E átomos do elemento hidrogênio, na maioria delas.
¢ Para
que certo heteroátomo possa estar entre carbonos é necessário que ele faça pelo
menos duas ligações covalentes. É o caso, por exemplo, dos átomos dos elementos
O, S, N e P, mas não de F, Cl, Br e I.
Recapitulando e Resumindo...
06.
Outras informações
importantes sobre esse assunto são:
1.
O
Benzeno;
2.
Classificação do Carbono;
3.
Classificação
das Cadeias Carbônicas;
4.
Algumas
formas de representação
de compostos orgânicos.
Quando os átomos de Carbono
se ligam em uma estrutura fechada chamamos suas cadeias de cíclicas (ou fechadas).
Os compostos aromáticos foram
descobertos em 1825 por Michael Faraday (1791-1867). O aromático
mais simples e um dos mais importantes é o benzeno,
que possui fórmula molecular C6H6. Essa fórmula indica que se
trata de um composto insaturado (ou
seja, ela tem 03 ligações duplas). Em
1865, Kekulé propôs para essa substância uma estrutura cíclica de seis átomos
de Carbono, com ligações duplas e simples alternadas. Mas, atualmente, o
equilíbrio entre essas estruturas não ocorre.

As cadeias ou compostos que
não possuem anel benzênico em suas estruturas são chamadas de cíclicas alifáticas (ou cadeias
alicílicas). Assim, todos os compostos de cadeia aberta são
considerados alifáticos, bem como os de cadeia cíclica não aromática. As "normais" não são ramificadas, pois estas possuem mais de duas extremidades livres. A saturada só tem ligações simples, enquanto as insaturadas possuem uma ou mais ligações dupla ou tripla.








Vejamos mais algumas formas de representação
de compostos orgânicos...
Podemos formar vários tipos de cadeias:
¢ O Carbono
formando uma cadeia cíclica: começa e termina no mesmo ponto.
¢ Maneira
Condensada: Repare
que não colocamos aqui os traços do Hidrogênio (mas suas quantidades em
número).
¢ Forma de Bastão: Cada vértice ou
“canto” do bastão representa um Carbono (veja as setas). Na forma de
bastão, não representamos os Hidrogênios de modo algum.
¢ Como
passar da fórmula estrutural para a forma de bastão: Se na forma
de bastão não aparecem os hidrogênios, e cada vértice tem um carbono,
então... (Butano). Representação bond line.
Considerações Finais:
É isso, pessoal! Vou postar
aqui também alguns Modelos Moleculares de “Esfera e Vareta”. Em seguida, o
trabalho individual que passei para vocês.
Vale
ressaltar que:
¢ Trata-se de uma das maneiras usadas pelos químicos
para representar tridimensionalmente as moléculas.
¢ As imagens que serão vistas são usadas pelos
químicos para representar tridimensionalmente as moléculas. Veremos o nome
de cada uma delas e faremos a fórmula estrutural (mista = em cadeia
dos Carbonos e simplificada dos Hidrogênios).
¢ A fórmula estrutural geralmente não permite
representar de modo adequado a geometria de uma molécula orgânica, pois a
fórmula estrutural é escrita em um plano (papel, lousa etc.) e as moléculas, em
geral, não possuem estrutura planar, mas
sim tridimensional.
PESQUISA: Trabalho Individual.
Pessoal, o trabalho parece simples. Em verdade é! Mas, pode ficar confuso se vocês não souberem diferenciar um nome do outro ou um conceito do outro. Então vou detalhar os 05 pontos que devem ser feitos nesse trabalho por vocês, dando um exemplo com a molécula da Glicose. Veja só como ficaria:
Para facilitar um pouco as coisas, vou apresentar para vocês as duas moléculas na fórmula estrutural em cadeia simplificada (3º item). Agora é cada um e cada uma pegar a sua molécula e fazer as demais representações. Bom trabalho e... Caprichem!
Considerações Finais:
- Alifático = Compostos que não possuem anel benzênico em suas estruturas, como os compostos de cadeia aberta (ou acíclica) e os de cadeia cíclica não aromática.
- Na terminologia das ligações, o naftaleno (naftalina) considera-se como um híbrido de ressonância de três estruturas.
- O
benzopireno é um composto aromático formado na combustão da hulha
(qualquer carvão mineral) e do fumo. Pode ser encontrado em carnes grelhadas,
em carvão ou peças defumadas. Experiências em animais comprovaram sua potente
ação cancerígena. Apresenta a seguinte fórmula estrutural:
Exercícios Sobre Classificação Do Carbono
A classificação do carbono na cadeia
carbônica é feita basicamente em primário, secundário, terciário,
quaternário
e saturado
ou insaturado.
Aquele Abraço!
Neilton Lima
Professor
de Química.